Четыре атома содержатся в формульной единице вещества:
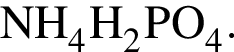
Четыре атома содержатся в формульной единице вещества:
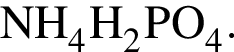
Число нейтронов в составе атома ![]() равно:
равно:
Число электронов на внешнем энергетическом уровне сульфид-иона равно:
Неметаллические свойства усиливаются в ряду элементов:
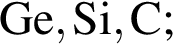
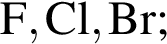
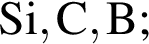
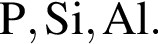
Ионная связь имеется во всех веществах ряда:
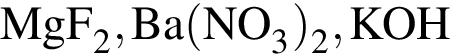
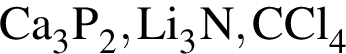
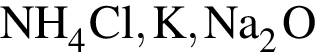
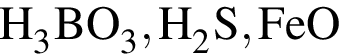
Установите соответствие между формулой вещества и степенью окисления в нем атома химического элемента,указанного в скoбках.
1) Li3N(N)
2) KHS(S)
3) CuSiO3(Si)
a) –3
б) –2
в) –1
г) +4
д) +6
Установите соответствие между формулой частицы и числом электронов, которые образуют химические связи в этой частице.
1 — ![]()
2 — ![]()
3 — ![]()
а — 2
б — 4
в — 5
г — 6
Простое вещество, в реакции с которым водород является окислителем:
Сульфид железа(II) массой 10,56 г полностью растворили в избытке соляной кислоты массой 290 г. Масса (г) образовавшегося раствора после завершения реакции составляет (растворимостью выделяющегося газа пренебречь):
Укажите НЕВЕРНОЕ утверждение:
Твёрдый гидроксид калия целесообразно использовать для осушения влажного газа:
Основания образуются в результате превращений:
а — 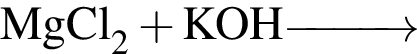
б — 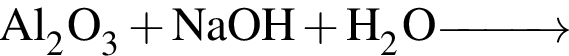
в — 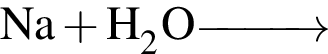
г — 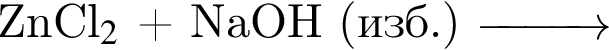
Используя в качестве реагента только разбавленную серную кислоту, в одну стадию НЕВОЗМОЖНО осуществить превращение:


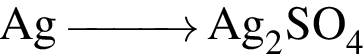

Относительно вещества, формула которого ![]() верно:
верно:
а — имеет название хлорид железа(III)
б — реагирует с растворами гидроксида натрия и нитрата серебра(I)
в — окисляется хлором до хлорида железа(III)
г — можно получить при взаимодействии железа с соляной кислотой
Укажите вещества, водные растворы которых содержат одинаковые ионы (гидролиз веществ и диссоциацию воды не учитывайте):
а) 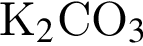
б) ![]()
в) 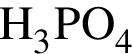
г) 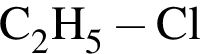
Исходные концентрации веществ А и В, участвующих в одностадийной реакции А + В = С, равны соответственно 0,68 моль/дм3 и 1,2 моль/дм3. Через 40 с после начала реакции концентрация вещества А снизилась до 0,28 моль/дм3. Средняя скорость (моль/дм3 · с) данной реакции и концентрация вещества В (моль/дм3) через 40 с после начала реакции равны соответственно:
Избыток газа, полученного действием серной кислоты на известняк, пропускают в стакан с известковой водой. При этом в стакане:
Цинковую пластинку погрузили в разбавленный водный раствор, в результате чего масса пластинки уменьшилась. В исходном растворе находилось вещество:
Только окислительные свойства в химических реакциях может проявлять вещество, формула которого (возможность окисления ![]() не учитывайте):
не учитывайте):
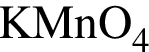
Укажите сумму молярных масс (г/моль) алюминийсодержащих продуктов А и Б в следующей схеме превращений:
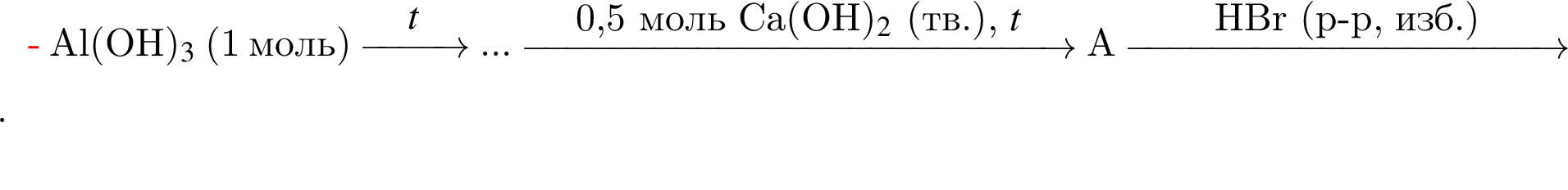
Образование ![]() из простых веществ протекает по термохимическому уравнению
из простых веществ протекает по термохимическому уравнению 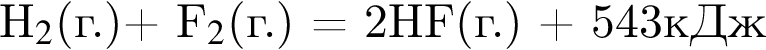 . При разрыве связей в молекулах
. При разрыве связей в молекулах ![]() количеством 1моль поглощается 436кДж теплоты, а при образовании связей в молекулах
количеством 1моль поглощается 436кДж теплоты, а при образовании связей в молекулах ![]() количеством 1моль выделяется 569кДж теплоты. Укажите количество теплоты (кДж), которая поглощается при разрыве связей в молекулах
количеством 1моль выделяется 569кДж теплоты. Укажите количество теплоты (кДж), которая поглощается при разрыве связей в молекулах ![]() количеством 1моль:
количеством 1моль:
Смесь азота и кислорода объёмом (н. у.) 400 см3 пропустили над металлическим литием. В результате смесь полностью поглотилась с образованием нитрида и оксида лития. Масса твёрдого вещества при этом увеличилась на 0,545 г. Укажите плотность (г/дм3, н. у.) исходной смеси азота с кислородом:
В водном растворе аммиака установилось следующее равновесие:  . Количество молекул
. Количество молекул ![]() в растворе увеличится, если добавить в раствор:
в растворе увеличится, если добавить в раствор:
а) порцию воды;
б) немного твердого гидроксида натрия;
в) немного твердого сульфата аммония;
г) немного углекислого газа.
Окислительно-восстановительной реакцией является реакция, схема которой:
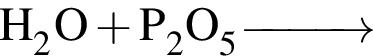
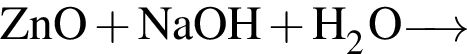
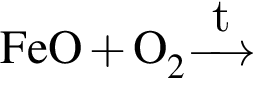
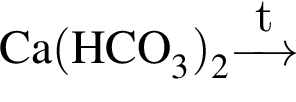
К увеличению ![]() водного раствора приведет:
водного раствора приведет:
Для подкормки растений на 1 м2 почвы необходимо внести азот массой 11,2 г и калий массой 11,7 г. Укажите массу (г) смеси, состоящей из аммиачной и калийной селитры, которая потребуется, чтобы растения получили необходимое количество азота и калия на поле площадью 100 м2.
К классу алкинов относится вещество, название которого:
Из соединения, формула которого
индивидуальные аминокислоты можно получить в результате реакции:
Альдегид А имеет молярную массу меньше 31 г/моль, при гидрировании образует вещество Б молярной массой больше 31 г/моль. При взаимодействии Б с иодоводородом образуются органическое вещество В и неорганическое вещество Г. При окислении Б может быть получено органическое вещество Д, водный раствор которого окрашивает лакмус в красный цвет. Укажите сумму молярных масс (г/моль) веществ В и Д.
Выберите утверждения, справедливые для этанола:
1) при взаимодействии с бромоводородом образует сложный эфир
2) температура кипения выше, чем у вещества, формула которого 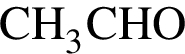
3) при взаимодействии с натрием продуктами реакции являются 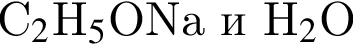
4) при взаимодействии с уксусной кислотой в присутствии серной кислоты образует метиловый эфир уксусной кислоты
5) при дегидратации может быть получен этилен ![]()
6) образуется при восстановлении уксусного альдегида водородом
Ответ запишите в виде последовательности цифр в порядке возрастания, например: 135.
Газообразная смесь алкана с этеном имеет объем (н. у.) 13,44дм3. Половину смеси пропустили через сосуд с избытком бромной воды. При этом масса сосуда с содержимым выросла на 3,5г. Вторую половину смеси сожгли в избытке кислорода, в результате чего образовалась вода массой 10,8 г. Определите молярную массу (г/моль) смеси углеводородов.
Укажите сумму молярных масс (г/моль) органических веществ Х3 и Х4, образующихся в результате следующих превращений:
В четырех пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
— вещества из пробирок № 1 и № 4 нейтрализуют друг друга;
— вещества из пробирок № 3 и № 1 реагируют между собой с образованием голубого осадка;
— при добавлении к содержимому пробирки № 2 вещества из пробирки № 4 выпадает белый осадок.
Установите соответствие между названием неорганического вещества и номером пробирки, в которой находится раствор данного вещества.
А) хлорид бария
Б) нитрат меди(II)
В) гидроксид натрия
Г) серная кислота
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4B2ГЗ.
Определите степень полимеризации вещества Г, имеющего относительную молекулярную массу 241 920, которое образуется, в результате следующих превращений:
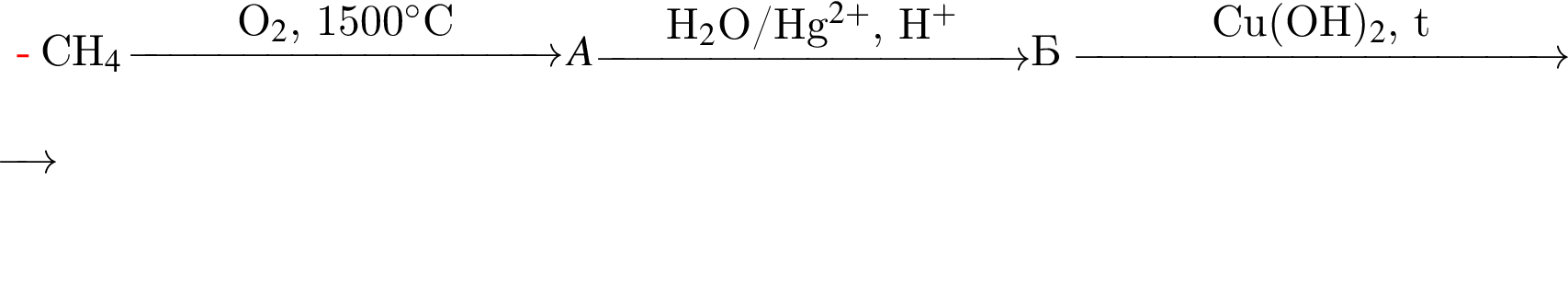
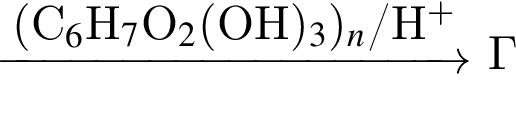
Вещество Г не содержит гидроксильных групп.
В четырех пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
— вещества из пробирок 1 и 2 нейтрализуют друг друга;
— вещества из пробирок 1 и 3 реагируют друг с другом с выделением газа (н. y.) без цвета и запаха;
— содержимое пробирок 2 и 4 взаимодействует с выделением газа (н. у.) с резким запахом, обладающего основными свойствами.
Установите соответствие между содержимым пробирки и её номером.
А) гидроксид калия
Б) карбонат натрия
В) нитрат аммония
Г) хлороводородная кислота
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б1В3Г4.
Уксусный ангидрид 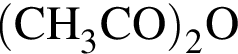 легко взаимодействует с водой, образуя уксусную кислоту:
легко взаимодействует с водой, образуя уксусную кислоту:
Какой объем (см3) водного раствора уксусной кислоты с массовой долей  90% (
90% (![]() = 1,06 г/см3) следует добавить к 120 г раствора уксусного ангидрида в уксусной кислоте с массовой долей
= 1,06 г/см3) следует добавить к 120 г раствора уксусного ангидрида в уксусной кислоте с массовой долей 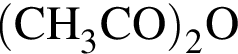 45%, чтобы получить 20-процентный раствор уксусного ангидрида?
45%, чтобы получить 20-процентный раствор уксусного ангидрида?
К раствору медного купороса массой 48 г с массовой Долей сульфата меди(II) 8% добавили некоторое количество насыщенного раствора сульфида натрия. Растворимость сульфида натрия в условиях эксперимента составляла 25 г на 100 г воды. После отделения осадка оказалось, что концентрация (моль/дм3) ионов ![]() в растворе в девять раз больше, чем
в растворе в девять раз больше, чем ![]() Определите массу (г) насыщенного раствора сульфида натрия, использованного в описанном эксперименте.
Определите массу (г) насыщенного раствора сульфида натрия, использованного в описанном эксперименте.
В стакан с водным раствором гидрокарбоната бария добавили негашеную известь и перемешали. После фильтрования смеси осталась чистая вода, а масса твердого остатка составила 53 г. Вычислите массу (г) добавленной извести. Ответ округлите до целых.
Свинцовую пластинку массой 70 г опустили в раствор нитрата меди(II) массой 380 г. В момент извлечения пластинки из раствора массовая доля нитрата свинца в растворе оказалась равной 4,3 %. Вычислите, насколько процентов уменьшилась масса пластинки после извлечения ее из раствора.
Образец сплава никеля с оловом массой 29,12 г полностью растворили в избытке соляной кислоты. Металлы при этом перешли в степень окисления +2. В образовавшийся раствор погрузили железную пластинку массой 50 г и выдерживали до прекращения протекания реакций. Масса пластинки осталась равной 50 г. Рассчитайте массу (г) соли в конечном растворе. Ответ округлите до целых.
Загрязненный аммиак объемом 32 м3 (н. у.) содержит 10% примесей (по объему). В результате поглощения всего аммиака избытком азотной кислоты была получена аммиачная селитра. Учитывая, что для подкормки одного плодового дерева необходимо 45 г химического элемента азота, рассчитайте, какое количество деревьев можно подкормить, используя полученную селитру.
Тепловой эффект реакции образования карбоната кальция из оксидов составляет 178 кДж/моль. Для полного разложения некоторого количества карбоната кальция потребовалось 64,08 кДж теплоты. Полученный оксид кальция спекали с углем массой 18 г в электропечи. Вычислите массу (г) образовавшегося при этом бинарного соединения, в котором массовая доля кальция равна 62,5%. (Примесями пренебречь.)
Электролиз водного раствора, содержащего хлорид калия массой 268,2 г, протекает по схеме
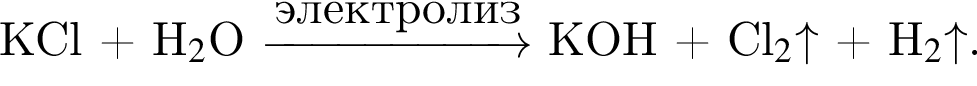
Рассчитайте объем (н. у., дм3) выделившегося в результате реакции хлора, если его выход составляет 60%.
Порцию кристаллогидрата соли 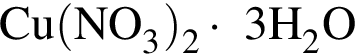 прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 3 дм3 имеет
прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 3 дм3 имеет ![]() Рассчитайте массу (г) черного порошка.
Рассчитайте массу (г) черного порошка.